Quantum Number 양자수 | (2026-01-20) |
▷
Top
▷
기초과학
▷
물리
▷
원자구조/성질
▷
원자껍질, 전자궤도
▷
양자수
1. 양자 수 (Quantum Number) ㅇ 원자 내 전자의 양자 상태를 규정하는 4가지 고유한 수 - 전자의 에너지, 각운동량, 공간적 방향, 스핀 상태를 기술함 2. 양자수의 특징 ㅇ 이산적임 (Quantization) - 원자 내 전자의 관측되고(관측가능량), 보존되는(보존성), 물리량(에너지, 각운동량 등)은 - 연속적이지 않고 이산적인 값만 허용됨 ㅇ 파동함수와의 관계 - 전자의 모든 물리적 상태 정보는, 파동함수 ψ로써 표현됨 . 이 파동함수는, 슈뢰딩거 방정식의 고유해(고유함수)로 얻어짐 - 각각의 양자수는 전자 파동함수의 상태를 규정짓는 고유한 지표 - 즉, 허용된 양자수 값 ↔ 허용된 고유 에너지 및 고유 상태 ㅇ 양자수의 종류 : 4가지 - 원자 내 전자의 특정 운동 상태는, 4가지 양자수(n,l,ml,ms)의 조합으로 완전 결정됨 . 주 양자수 (n) : 전자의 에너지 준위, 오비탈 크기 . 부 양자수/각운동량 양자수 (l) : 오비탈의 모양 . 자기 양자수 (ml) : 오비탈의 공간적 방향 . 스핀 양자수 (ms) : 전자의 고유 스핀 상태 ㅇ 파울리 배타 원리 - 한 원자 내에서 두 전자가 동일한 4개의 양자수 조합을 가질 수 없음 . 각 오비탈에는 최대 2개의 전자가 있을 수 있으나, . 이마저도, 스핀 방향이 반대인 2개 전자 만 존재 가능 3. 주 양자수 (Principle Quantum Number) : n ㅇ n = 1, 2, 3, ... (양의 정수) ㅇ 물리적 특징 : 공전 궤도 반경 (궤도 반경 크기) - 주양자수 n은 보어 모델 식에서의 n을 말함 (이에따라 궤도 반경도 결정됨) ㅇ 양자화 특징 : 궤도 에너지의 양자화 (궤도함수 에너지 크기) - 궤도함수 에너지 크기는, 주로, 주양자수 n 값에 의존하지만, - 부양자수 l 값에도 일부 의존함 4. 부 양자수 (Subsidiary Quantum Number) 또는 각운동량 양자수 : l ㅇ l = 0, 1, 2, 3, ... , n-1 (주양자수에 의존하는 정수) ㅇ 물리적 특징 : 전자 구름의 모양 (궤도함수의 모양) ㅇ 양자화 특징 : 각 운동량의 양자화 - 전자의 각운동량 크기는, {# \sqrt{l(l+1)}\hbar #} ㅇ 한편, 특정 궤도함수와 l 값과의 관계를, 문자와 관련시켜 호칭함 - l = 0 : s 궤도함수 (구형) - l = 1 : p 궤도함수 (아령형) - l = 2 : d 궤도함수 (특정 배향, 네잎클로버 모양) - l = 3 : f 궤도함수5. 자기 양자수 (Magnetic Quantum Number) : ml ㅇ ml = -l,-(l-1),...,0,...,l-1,l ( 즉, 2l+1개 { 1,3,5,7,... } ) - 각 n에 대해, ml 값의 수 = n2 . n = 1 : 1개, n = 2 : 4개, n = 3 : 9개, ... - 각 l에 대해, ml 값의 수 = 궤도함수의 수 . s 궤도함수 : 1개, p 궤도함수 : 3개, d 궤도함수 : 5개, f 궤도함수 : 7개, ... ㅇ 물리적 특징 : 궤도면의 방향/기울기 (궤도면 배향) ㅇ 양자화 특징 : 공간 양자화 (궤도함수 방향의 양자화) - 원자가 자기장 내에 있을 경우에, 각 운동량 방향에 대한 양자화 ☞ 공간 양자화 참조
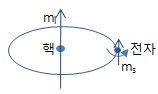
7. 스핀 양자수 (Electron Spin Quantum Number) : ms ㅇ ms = +½ (up-spin,↑), -½ (down-spin,↓) ㅇ 전자 스핀 양자수가 3가지 양자수(n,l,ml)와 다른 점 - 위 3 양자수가 원자 내 궤도함수의 크기(에너지)/모양/방향을 나타내지만, - 스핀 양자수는 마치 전하 종류(양,음) 처럼 전자 고유의 성질을 나타냄 . 2 이상의 전자가 존재할 때 만 의미(구별) 있음
"본 웹사이트 내 모든 저작물은 원출처를 밝히는 한 자유롭게 사용(상업화포함) 가능합니다"
[정보통신기술용어해설]