Polar Molecule 극성 분자 | (2025-05-04) |
무 극성 분자, 비 극성 분자, Polar Covalent Bond, 극성 공유결합, Nonpolar Covalent Bond, 비 극성 공유결합 | |
▷
Top
▷
기초과학
▷
화학
▷
화학결합
▷
결합의 극성
1. 극성 유무에 따른 공유결합의 구분 ㅇ 극성 공유결합 (polar covalent bond) : 전자쌍이 각 원자에 비 균등 공유 - 원자간 전기음성도 차이로부터 야기되는, 전자의 비 대칭적인 공유의 결과임 - 극성 분자 (Polar Molecule) . 전기적으로 극성을 가지는 분자 . 분자 내 전자들이 고르게 분포하지 않고 한쪽으로 치우쳐 있음 . 이로 인해, 분자 전체에 부분적인 양극(+)과 음극(-)이 생김 - 例) . H2O(물) : 산소(O) 원자가 수소(H) 원자 보다 전자를 더욱 끌어당기어 극성 . NH3(암모니아) : 질소 원자 주변에, 1개의 고립전자쌍과 3개의 극성인 N-H 결합 . HCl(염화수소) : 염소(Cl)가 수소(H) 보다 전기음성도가 크므로 결합 전자쌍을 더 끌어당김 ㅇ 비 극성 공유결합 (nonpolar covalent bond) : 전자쌍이 각 원자에 균등,대칭 공유 - 같은 원자 또는 대칭적인 구조 또는 원자간 전기음성도 차이가 매우 작은 경우임 - 例) Cl2(염소), H2(수소), N2(질소), CH4(메탄) : 비 극성 분자 ※ 사실, 대부분의 화합결합(분자 형성)이 이상적인 형태 보다는, - 부분적인 이온결합, 부분적인 공유결합을 동시에 갖는 중간적 `극성 공유 결합` 형태임 - 例) 플루오린 화합물이 여러 유형인 것처럼, 실제 물질은 그 중간 어딘가에 위치하는 경우 많음 . F2 : 비 극성 공유결합 (두 동일 원자 간의 전기음성도 차이가 없으므로 비극성) . HF : 극성 공유결합 (H와 F의 전기음성도 차이가 커서 극성임) . LiF : 이온결합 (Li는 전자를 거의 완전히 F에 줌) .. 이온 결합은, 개별 전자가 한 원자에 완전히 이동한 형태임 2. 극성의 유형 ㅇ 극성 결합이지만, 극성 분자가 아닌 경우 - 例) CO2 . 분자 기하구조가 선형(직선)적이어서, 2개 결합 극성이 상쇄되므로, . 알짜 쌍극자 모멘트가 없게 되어 극성 분자가 아님 ㅇ 극성 결합이면서, 극성 분자가 되는 경우 - 例) H2O(물) : O-H 결합 각각이 극성을 가지는 극성 분자 ㅇ 분자 기하 구조는 같으나, 다른 극성을 갖는 경우 - 例) CF4 (사불화탄소), CHCl3 (클로로포름) . 두 분자 모두 사면체 구조(Tetrahedron) .. CF4 : C-F 결합은 극성이지만, 네 방향이 대칭 → 극성 상쇄 → 비극성 분자 .. CHCl3 : C-H, C-Cl 결합이 대칭이 아니고 전기음성도 차이가 크므로, Cl 원자들이 비대칭적으로 배치됨 → 극성 분자 3. 극성의 척도 ※ 분자 내 개개의 극성결합과 비공유전자쌍의 벡터합에 의해 전체 극성이 결정되며, - 분자 극성의 크기는, 전기 쌍극자 모멘트로 측정됨 ㅇ 전기 쌍극자 모멘트의 척도 단위 => Debye [D] - 1 [D] = 3.34 x 10-30 [Coulomb m] - 例) 2개의 전자 전하(+1 및 -1 [e])가 1 [Å] 만큼 떨어져 있는 경우의 쌍극자 모멘트는,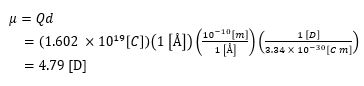
"본 웹사이트 내 모든 저작물은 원출처를 밝히는 한 자유롭게 사용(상업화포함) 가능합니다"
[정보통신기술용어해설]