알케인 분류, 알케인 종류 | (2025-07-28) |
알칸 분류, 알킨 종류, Ethane, 에테인, 에탄, Propane, 프로페인, 프로판, Butane, 부테인, 뷰테인, 부탄, 사이클로 알케인 | |
▷
Top
▷
기초과학
▷
화학
▷
유기화학
▷
알칸계/알케인계
1. 사슬형 알케인(포화 탄화수소)의 분류 : CnH2n+2 ☞ 탄화수소, 알케인 참조ㅇ 명칭 접미사 : -ane (~에인) (IUPAC 한국어 혼용 가능) ㅇ 포화 탄화수소 : 모든 탄소 - 탄소 결합이, 단일결합이며, 작용기 없음 2. 탄소의 개수에 따른 분류 ☞ 그리스어 수 접두사 참조 ㅇ 종별 - 메테인(methane)/메탄 : 탄소 1개 (CH4) - 에테인(ethane)/에탄 : 탄소 2개 (C2H6) - 프로페인(propane)/프로판 : 탄소 3개 (C3H8) - 부테인(butane)/부탄 : 탄소 4개 (C4H10) - ..... - 데케인(decane) : 탄소 10개 (C10H22) - 운데케인(undecane)/운데칸 : 탄소 11개 (C11H24) - 도데케인(dodecane)/도데칸 : 탄소 12개 (C12H26) - 트리데케인(tridecane)/트리데칸 : 탄소 13개 (C13H28) - 테트라데케인(tetradecane)/테트라데칸 : 탄소 14개 (C14H30) - 펜타데케인(pentadecane)/펜타데칸 : 탄소 15개 (C15H32) - ..... - 에이코세인(eicosane)/에이코산 : 탄소 20개 (C20H42)
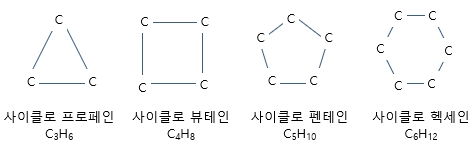
* (명칭 : 어미가 `~에인(-ane)`) ㅇ 메테인/메탄 (Methane) : 탄소 1개 (CH4) - 구조식 : CH4 - 탄소가 단일 결합 4개를 형성하며 사면체 구조 ☞ 분자구조 참조 . 탄소 원자를 중심으로, 수소(H) 4개가, 각각 3차원적으로 109.5˚각도로 균등 분포 함 . 탄소 원자가, 4개 sp3 혼성 궤도함수로써, 4개 수소 원자와 결합 . 비극성 공유결합 - 이성질 현상 : 없음 ㅇ 에테인/에탄 (Ethane) : 탄소 2개 (C2H6) - 구조식 : CH3CH3 (H3C - CH3) - 2개의 탄소 간에 단일결합, 각 탄소의 나머지 3개의 가지손이 수소와 단일결합 . 두 탄소 간에 C-C σ결합을 이루며, . 나머지 3개 가지손이 C-H σ결합을 이룸 . 두 CH3기 간에 회전이 일어날 수 있음 - 이성질 현상 : 없음 - 특징 . 유기물 중 C-C 단일결합을 하는 분자 중 가장 작음 . 비 극성 공유결합 임 .. 공유 전자쌍 만 있고, 비공유 전자쌍 없음 . π결합 없음, C-C,C-H σ 결합 만을 갖음 . 별도의 작용기를 갖지 않음 . 따라서, 반응성이 매우 낮음 . 무색 무취의 기체 .. 천연 가스,석유 분해 가스 내 포함된 성분임 - [참조] ☞ 에탄올/에틸알코올 등 ㅇ 프로페인/프로판 (Propane) : 탄소 3개 (C3H8) - 구조식 : CH3CH2CH3 - 3개의 탄소 간에 단일결합, 각 탄소의 나머지 가지손이 수소와 단일결합 - 이성질 현상 : 없음 - 특징 . 원유를 정제하며 등유나 휘발유를 만들 때 부산물로 나옴 . 일상에서는, 약한 석유 냄새가 나는 무색의 기체이지만, 압력을 가하면, 액체가 됨 . 녹는점 : -187.69 ℃, 끓는점 : -42.1 ℃ - 프로판 가스의 연소에 대한 화학반응식 . CH (g) + 5O (g) → 3CO (g) + 4HO (l) ㅇ 부테인/부탄 (Butane) : 탄소 4개 (C4H10) - 구조식 : CH3CH2CH2CH3 (n-부탄) - 부테인 처럼 큰 알케인들에서, 구조 이성질 현상을 보임 - 이성질체 수 : 2개의 구조 이성질체를 갖음 . 곧은 사슬 구조의 분자 (노말 부탄, n-부탄) : 끓는점 -0,5 ℃ . 곁가지를 가진 사슬 구조의 분자 (이소부탄, i-부탄) : 끓는점 -12 ℃ - 이와같이, 탄소 수가 4개 이상이면, 구조 이성질체를 갖게됨 ㅇ 펜테인/펜탄 (Pentane) : 탄소 5개 (C5H12) - 이성질체 수 : 3개의 구조 이성질체를 갖음 . n-펜테인 : 곁가지가 없는(unbranched) 탄소 5개를 포함하는, 비극성 포화 탄화수소(saturated hydrocarbon) . 아이소펜테인 : (CH)CHCHCH . 네오펜테인 : C(CH), 메테인의 4개의 수소 원자가 전부 메틸기와 치환된 형태를 취함 ㅇ 헥세인/헥산 (Hexane) : 탄소 6개 (C6H14) - 이성질체 수 : 5개의 구조 이성질체를 갖음 ㅇ 헵테인/헵탄 (Heptane) : 탄소 7개 (C7H16) - 이성질체 수 : 9개의 구조 이성질체를 갖음 ㅇ 옥테인/옥탄 (Octane) : 탄소 8개 (C8H18) - 이성질체 수 : 18개의 구조 이성질체를 갖음 ㅇ 노네인/노난 (Nonane) : 탄소 9개 (C9H20) - 이성질체 수 : 35개의 구조 이성질체를 갖음 ㅇ 데케인/데칸 (Decane) : 탄소 10개 (C10H22) - 이성질체 수 : 75개의 구조 이성질체를 갖음 2. 상과 분자간 인력 ㅇ 탄소의 개수에 따라, 실온에서 다른 상(Phase)으로 존재 * 분자량이 커질수록, 분자간 반데르발스 인력이 강해져, 끓는점,녹는점이 올라감 - 대략적 상 (실온, 약 25°C)에서, . 탄소수 1 ~ 4개 : 기체 (메탄 ~ 부테인) . 탄소수 5 ~ 18개 : 액체 (펜테인 ~ 옥타데칸 정도) . 그 이상의 탄소수인 경우 : 고체 (사슬 길이,분지/가지 정도에 따라 차이) 3. 물리적 성질과 가지(분지)의 영향 ㅇ 동일 탄소수의 가지가 많은(분지된) 알케인은, 직쇄형보다 끓는점이 낮음 - (표면적 감소 → 분자간 인력 감소) ㅇ 밀도는 대개 증가하지 않으며, 가지,입체에 따라 약간 변함 4. 이성질체(구조 이성질체)와 수 ㅇ 탄소 수가 늘어나면, 가능한 구조 이성질체 수가 급증 - 例) 4개 (부탄) → 2종, 5개 → 3종, 6개 → 5종, 7개 → 9종, 8개 → 18종, 9개 → 35종 등 ㅇ 이성질체는 사슬의 분지(가지) 유무와 위치에 의해 달라지며, - 물리적 성질(끓는점 등)에 큰 영향을 줌 5. 입체,구조 관련 특이한 점 ㅇ 단일결합 만 있는 알케인에선, 입체 이성질체가 흔하지 않음 - (입체 이성질체 : 원자 간 연결 방식은 같지만 공간적 배열이 다름) ㅇ 다만, - 단일결합 주위의 회전에 의해 서로 다른 배치가 존재 - 사이클로 알케인에서는 고리의 기하학이 중요 6. 고리형 알케인계 : 사이클로 알케인, 시클로 알케인 (Cycloalkane) : CnH2n ㅇ 탄소 원자 연결 형태가 고리형을 취함 ㅇ 분자식 : CnH2n ㅇ 명명법 : 탄소 수가 같은 비 고리형 알케인의 앞에, 사이클로(cyclo-)를 붙임 ㅇ 골격 형태
"본 웹사이트 내 모든 저작물은 원출처를 밝히는 한 자유롭게 사용(상업화포함) 가능합니다"
[정보통신기술용어해설]