Subsidiary Quantum Number 부 양자수 | (2019-11-11) |
Azimuthal Quantum Number, 방위 양자수, Orbital Angular Momentum Quantum Number, 궤도함수 각운동량 양자수, 각운동량 양자수 | |
▷
Top
▷
기초과학
▷
물리
▷
원자구조/성질
▷
원자껍질, 전자궤도
▷
양자수
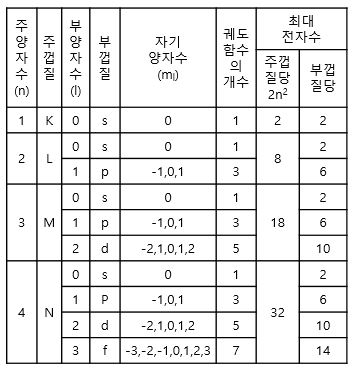
1. 부 양자수 (Subsidiary Quantum Number) : l ㅇ 수 규칙 : l = 0, 1, 2, 3, ... , n-1 ㅇ 물리적 특징 : 타원 궤도의 모양 (즉, 궤도함수의 3차원적 모양) ㅇ 양자화 특징 : 각 운동량의 양자화 ㅇ (기타명칭) - `궤도 양자수(Orbital)`, `방위 양자수(Azimuthal)`, `궤도함수 각운동량 양자수(Orbital Angular Momentum Number)` 라고도 불리움 2. 부 양자수의 표기 및 유형 구분 ㅇ 전자 배치의 기호 표기 - 부양자수 l = 0,1,2,3,... 각각에 대응하여 s,p,d,f,... 기호로 표기 . (각 명칭은 원자 선 스펙트럼에서의 선 이름에서 유래) .. sharp, principle, diffuse, fundamental ㅇ 유형 구분 - l = 0 => s 궤도함수 (구 대칭, 원형 모양) - l = 1 => p 궤도함수 (특정 배향, 아령형 모양) - l = 2 => d 궤도함수 (특정 배향, 네잎클로버 모양) - l = 3 => f 궤도함수 ㅇ n = 3 例)3. 원자 내 전자 껍질 구조 ㅇ 부껍질(부각,subshell, 부 에너지 준위) - s, p, d, f, ... 궤도함수 . s,p,d,f,... 각각에 1,3,5,7개의 다른 궤도함수가 존재함
ㅇ 최대 전자수 (각 부껍질 당) - s,p,d,f,... 각각에 2,6,10,14개의 전자가 채워짐
"본 웹사이트 내 모든 저작물은 원출처를 밝히는 한 자유롭게 사용(상업화포함) 가능합니다"
[정보통신기술용어해설]